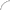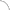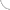Статьи
20.02.2017
Разные лица инсулиновой резистентности
В последние годы многие развитые страны столкнулись с эпидемическим ростом сахарного диабета 2-го типа (далее просто «диабет»).
По данным, приведенным в обзоре профессора Калифорнийского университета Джеролда Олефски (“Cell”, 2013, 152, 673–687, doi: 10.1016/j.cell.2013.01.041), этой формой диабета страдают более 300 миллионов человек во всем мире, из них 55 миллионов в Индии, 25 миллионов — в США и 80 миллионов в Китае, причем количество пациентов удваивается каждые 10–15 лет. Диабет второго типа развивается, когда некоторые ткани пациента малочувствительны к действию инсулина, то есть приобретают инсулинорезистентность. Этот недуг не следует путать с более редким диабетом 1-го типа (юношеским диабетом) — заболеванием, при котором иммунные клетки по неустановленной причине атакуют специализированные бета-клетки поджелудочной железы, вырабатывающие гормон инсулин, и разрушают их.
В результате поджелудочная железа не в состоянии синтезировать достаточное количество инсулина, и больные вынуждены регулярно его вводить. Любой диабет опасен тяжелейшими осложнениями: слепотой, нарушениями свертываемости крови, кровоснабжения конечностей, работы нервной и сердечно-сосудистой систем.
Пытаясь бороться с диабетом 2-го типа, врачи и исследователи обращают особое внимание на его грозный предвестник — инсулинорезистентность. Основная физиологическая функция инсулина заключается в том, чтобы обеспечивать поступление глюкозы из периферической крови в клетки (прежде всего мышечной и жировой ткани) и подавлять избыточную продукцию глюкозы в клетках печени. Эту задачу он выполняет, стимулируя экспрессию особых белков-транспортеров, которые перетаскивают глюкозу из периферической крови через клеточную мембрану внутрь клетки (рис. 1). В результате действия инсулина количество белков-транспортеров на мембране возрастает в 5–10 раз, а их содержание внутри клетки уменьшается на 50–60%.
Чувствительность клеток к инсулину зависит прежде всего от количества инсулиновых рецепторов и их активности. Так, жировые клетки и гепатоциты (клетки печени) содержат по 200–300 тысяч рецепторов, а моноциты и эритроциты — на порядок меньше. Количество рецепторов и их сродство (аффинность) к инсулину непостоянны: у здоровых людей они выше вечером и ночью, а утром ниже; возрастают при физических нагрузках, уменьшаются у пожилых людей. В норме инсулин также вызывает релаксацию гладкомышечной стенки сосудов за счет высвобождения оксида азота, однако и эта способность нарушена у пациентов с инсулинорезистентностью и ожирением.
Если восприимчивость периферических тканей к действию инсулина по какой-то причине снижена, у человека развивается компенсаторная гиперинсулинемия — его поджелудочная железа синтезирует и выделяет в кровь повышенное количество инсулина. Пока бета-клетки могут работать в авральном режиме и поддерживать в плазме крови уровень гормона, достаточный для преодоления инсулинорезистентности, у пациентов сохраняется нормальная концентрация сахара в крови. Однако резервы поджелудочной железы не безграничны, бета-клетки «выдыхаются», и тогда уровень сахара начинает расти.
Ситуация усугубляется тем, что при инсулинорезистентности неправильно работает печень. Обычно этот орган поддерживает необходимую концентрацию сахара, расщепляя гликоген или синтезируя глюкозу из веществ неуглеродной природы. Когда уровень инсулина возрастает, здоровая печень снижает продукцию глюкозы. А при инсулинорезистентности печень как ни в чем не бывало продолжает выбрасывать ее в кровь, что вызывает у голодного пациента гипергликемию.
Иными словами, когда бета-клетки утрачивают способность постоянно наращивать продукцию гормона, инсулинорезистентность перетекает в сахарный диабет 2-го типа, для которого характерны хроническая нехватка инсулина и, как следствие, повышенное содержание глюкозы в крови. Однако уровень сахара в крови — это только индикатор проблемы, суть которой заключается в том, что глюкоза не может попасть в клетки, они голодают и плохо выполняют свои функции.
Вопрос о причинах возникновения инсулинорезистентности остается открытым. Установлено, что она чаще развивается при избыточной массе тела и ожирении, у людей старше 45 лет, при недостаточной физической нагрузке, стрессе и повышенном артериальном давлении. Каким же образом ожирение содействует развитию инсулинорезистентности?
Ожирение и воспаление
Специалисты Национального института диабета США более 30 лет изучали индейцев племени пима, живущих в Аризоне и Мексике. Они установили, что половина всех взрослых индейцев, населяющих резервации на территории Аризоны, болеют диабетом и 95% из них страдают от ожирения, а у мексиканских пима это заболевание наблюдается редко, и ожирение им не свойственно, потому что они едят низкокалорийные продукты с высоким содержанием пищевой клетчатки и физически гораздо активнее, чем их заграничные единоплеменники. Исследователи пришли к выводу, что главный фактор риска в развитии диабета 2-го типа — ожирение. Причем риск возникновения ожирения можно снизить даже при наследственной предрасположенности к нему, если вести правильный образ жизни.
В последние десятилетия наблюдается эпидемический рост числа людей с избыточным весом (см.: Калория и ее история, «Химия и жизнь», 2013, № 2). Так, в США около 65% взрослых людей имеют лишний вес и около 32% страдают от ожирения. Как мы помним, ожирение часто сочетается с инсулинорезистентностью. Если масса человека превышает идеальную на 35–40%, то чувствительность к инсулину снижается более чем на 40%. Развитию инсулинорезистентности способствует и усиленный выход жирных кислот из адипоцитов (клеток жировой ткани) в кровь. Клинические исследования показали, что фармакологические ингибиторы липолиза (препараты, замедляющие расщепление жиров и тем самым снижающие уровень жирных кислот в крови) способны быстро вернуть пациентам с ожирением чувствительность к инсулину. Снижение веса также уменьшает поток жирных кислот и улучшает чувствительность к инсулину.
В организме существуют два основных способа энергетического обеспечения: «дневной» и «ночной». При «дневном» способе энергообеспечения главным источником энергии служит глюкоза и в меньшей степени — жир. При «ночном», напротив, организм черпает энергию в основном из жирных кислот, поступающих в кровь при расщеплении жировых отложений. По мнению ленинградского профессора-медика Владимира Михайловича Дильмана, при ожирении механизм суточного переключения энергетического гомеостаза нарушается, и организм переходит преимущественно на жировой путь обеспечения. Но почему это происходит?
Известно, что во взрослом организме количество жировых клеток постоянно. Накопление жира увеличивает объем адипоцита, что приводит к снижению плотности инсулиновых рецепторов на ее увеличенной поверхности, и чувствительность жировой ткани к действию инсулина падает. Однако если человек по-прежнему переедает, клетки вынужденно продолжают синтезировать жиры из тех излишков глюкозы, которые не могут быть «потрачены» в других органах. Поджелудочная железа отвечает на это дополнительным, компенсаторным увеличением продукции инсулина.
И всё же «накачка» адипоцитов жиром не может быть бесконечной. Когда жировая ткань перегружена, в ней нарастает гипоксия и часть адипоцитов погибает, вызывая воспаление. К очагу воспаления из костного мозга устремляются макрофаги. В норме жировая ткань содержит не более 5% макрофагов, но при ожирении их доля увеличивается до 50%. При этом макрофаги активируются и секретируют воспалительные цитокины — небольшие пептидные молекулы, обеспечивающие мобилизацию воспалительного ответа, — в частности, фактор некроза опухоли TNF-α (запомним эту аббревиатуру, она нам еще понадобится) и интерлейкин-6. Эти цитокины, в свою очередь, поддерживают инсулинорезистентность как в адипоцитах, так и в клетках печени и мышц (рис. 2).
Как установили американские исследователи под руководством профессора Стивена Гринспуна, директора клиники при Гарвардской медицинской школе (Бостон, США), нейтрализация провоспалительного TNF-α улучшает чувствительность к инсулину при ожирении (“Journal of Clinical Endocrinology & Metabolism”, 2011, 96: E146–E150). Это открытие позволило предположить, что при ожирении жировая ткань становится источником хронической активации воспаления, способного поддерживать инсулинорезистентность (рис. 2, 3). Механизмы такой активации местного и системного воспаления интенсивно изучают.
Однако воспаление — это не болезнь, а нормальная реакция организма, в частности, на бактериальную инфекцию. Цель воспаления — уничтожить бактерии с помощью цитотоксической реакции «респираторного», или «кислородного взрыва». Такое название она получила потому, что клетки-фагоциты, захватившие бактерии или продукты их распада, резко (взрывообразно) увеличивают потребление кислорода и глюкозы, которые участвуют в образовании высокоактивных радикалов, обладающих антибактериальной активностью. Реакция достигает максимума уже через 50–120 секунд после начала фагоцитоза. Для осуществления реакции «респираторного взрыва» необходима быстрая доставка большого количества глюкозы к активированным фагоцитам. Можно предположить, что такой направленный поток глюкозы обеспечивается с помощью физиологического механизма инсулинорезистентности, который временно ограничивает приток глюкозы в мышцы и жировые клетки, направляя ее главным образом в нейтрофилы и макрофаги (рис. 3).
Оказалось, что инсулинорезистентность регулирует потоки глюкозы и в других адаптационных ситуациях, во время беременности например.
Беременность и рост опухолей
Глюкоза — основной источник энергии для матери и плода. По мере роста плоду нужно всё больше глюкозы, причем ее потребление во второй половине беременности опережает ее доступность. Поэтому в норме уровень глюкозы в крови плода примерно на 10–20 мг/100 мл (0,6–1,1 ммоль/л) ниже, чем у матери. (Физиологическая норма для беременной женщины — 3,3–6,6 ммоль/л.) Обращает на себя внимание тот факт, что в период максимального роста плода у всех беременных развивается физиологическая инсулинорезистентность, с помощью которой, вероятно, потоки глюкозы и перенаправляются от органов матери к растущему плоду. Этот эффект регулирует плацента — основной источник секреции TNF-α во время беременности, особенно во второй ее половине. Примерно 94% плацентарного TNF-α высвобождается в кровоток матери, и только 6% — в кровоток плода. Таким образом, высокий уровень TNF-α обеспечивает инсулинорезистенность материнских тканей.
После родов его концентрация резко и быстро снижается, и параллельно восстанавливается чувствительность к инсулину. Однако у беременных с избыточной массой тела содержание TNF-α значительно выше, чем у беременных с нормальным весом. У чрезмерно полных женщин беременность часто протекает с осложнениями, и после родов чувствительность к инсулину не только не восстанавливается, но и возрастает риск развития диабета. Однако при правильном течении беременности адаптивная инсулинорезистентность помогает нормальному росту плода.
Эмбриональные ткани по изоферментному и антигенному составам, а также типу клеточного метаболизма (активации гликолиза) подобны опухолевым. Возникает вопрос: развивается ли инсулинорезистентность при опухолевом росте и если да, то к каким последствиям приводит?
Раковые клетки усваивают глюкозу в 10–30 раз активнее нормальных. Потребляя глюкозу со скоростью большей, чем скорость ее поступления, раковая опухоль действует как мощный насос, выкачивающий глюкозу из организма хозяина. Исследователи из Университета Южной Калифорнии Этан Оргел и Стивен Миттелмен показали, что большинство злокачественных опухолей вызывает инсулинорезистентность в мышцах, печени и жировой ткани больного параллельно с увеличением уровня провоспалительного TNF-α (“Current Diabetes Reports”, 2013, 13, 213–222, doi: 10.1007/s11892-012-0356-6). Это создает более выгодные условия для роста опухоли в ущерб нормальной работе здоровых органов и тканей.
Вопреки распространенному мнению, что больные раком умирают от метастазов в жизненно важные органы, многие из них погибают от комплекса болезней, известных под названием «паранеопластический синдром». Это вторичные неспецифические нарушения функций различных органов и систем, непосредственно не связанных с локализацией первичной опухоли. Паранеопластический синдром встречается у 60% онкологических больных. Он вызван нарастающим синтезом TNF-α, который в высокой концентрации превращается в эндотоксин, вызывающий системное воспаление и длительное ограничение поступления глюкозы в мышцы, печень и жировую ткань. В результате масса мышечной и жировой тканей уменьшается, и пациент заметно теряет в весе — так называемая раковая кахексия (рис. 3). Поэтому при онкологических заболеваниях целесообразно применять препараты, уменьшающие системное воспаление и повышающие чувствительность клеток печени, мышц и жировой ткани к действию инсулина. Они могут не только замедлить рост опухоли, но и предупредить развитие кахексии. Давно было замечено, что антидиабетические препараты (бигуаниды), восстанавливающие инсулинорезистентность, повышают эффективность лечения онкологических больных, но для предупреждения развития кахексии их не использовали, вероятно, из-за недостаточного внимания к эффекту инсулинорезистентности при опухолевом росте.
А еще резистентность к инсулину может привести к развитию синдрома поликистозных яичников (механизм развития не установлен). У женщин при этом заболевании нарушается менструальный цикл и развивается бесплодие. Полугодовое лечение наиболее известным бигуанидом метформином восстанавливает регулярный цикл овуляции.
Инсулинорезистентность — защитная реакция или болезнь?
Чтобы выбрать правильный ответ, необходим детальный анализ ситуации, при которой возникла инсулинорезистентность, хотя зачастую это становится отдельной непростой задачей. При неосложненной беременности или при развитии кратковременной реакции «респираторного взрыва», направленного на ликвидацию бактериальной инфекции, инсулинорезистентность представляет собой адаптивный, физиологически оправданный ответ. После родов или победы над инфекцией она проходит сама и не требует лечения. Однако, по данным профессора-биолога Я. А. Александровского, хроническое повышение уровня сахара в крови само по себе, без инфекции способно вызвать «затяжной респираторный взрыв» у нейтрофилов, которые, скапливаясь вблизи стенок сосудов, способны их повредить. Поэтому при диабете возрастает риск развития сосудистых осложнений. Иными словами, физиологическая воспалительная реакция по мере увеличения ее продолжительности приобретает патологические черты, и тогда ее действие направлено не столько против бактерий, сколько против сосудов.
Инсулинорезистентность рассматривают как предшественницу клинического проявления сахарного диабета 2-го типа, но она также может указывать на скрытое развитие опухолевого процесса. В таких ситуациях необходима более детальная диагностика, причем во время обследования человек должен избегать факторов риска: избыточного и неправильного питания, малой физической активности, эмоционального стресса. После обследования целесообразно корректировать устойчивость к инсулину с помощью бигуанидов, салицилатов и других противовоспалительных препаратов.
Нельзя не отметить удивительные открытия последних лет, сделанные в нескольких зарубежных лабораториях. По данным профессора Гарвардской медицинской школы Ричарда Ходина, прием кишечной щелочной фосфатазы смягчает негативные последствия избыточного употребления жирной пищи (“Proceedings of the National Academy of Sciences”, 2013, 110, 17, 7003–7008, doi:10.1073/ pnas.1220180110). Оказывается, некоторые представители кишечной микрофлоры могут поддерживать или подавлять развитие рака и диабета в организме хозяина. Более того, микрофлора, способствующая развитию диабета, иногда передается от больной диабетом беременной к плоду и таким путем повышает риск развития этой патологии у ребенка. Влияние микрофлоры на развитие диабета сейчас интенсивно исследуют, будущее покажет, насколько справедливы предположения ученых и возможно ли их использовать на практике.
Феномен инсулинорезистентности многолик. Природа экономно использует один и тот же механизм для достижения разных целей: он обеспечивает и антибактериальную защитную реакцию «респираторного взрыва», и нормальное развитие плода. Увы, неправильный образ жизни провоцирует патологическое течение процесса, и тогда инсулинорезистентность способствует возникновению ожирения, рака или диабета.
П. М. Шварцбурд,
доктор биологических наук, Институт теоретической и экспериментальной биофизики РАН, Пущино
«Химия и жизнь» №7, 2013
Художник В. Камаев
Источник: http://elementy.ru/lib/432116